イオン化について
前回メールマガジンVol.11でも紹介させていただきましたが、
鉄は「酸素」「水分」との接触、そして電子の移動「イオン化」で錆びていきます。
しかし全ての金属が「酸素」「水分」と接触した事で錆びるわけではありません。
例えば金、プラチナなどは自然界でも酸化する事なく単体で存在しています!
その理由は電子の移動「イオン化」しないからです。
通常物質を構成している原子には+の電気を帯びた陽子、-の電気を帯びた電子
この2種類が同じ数だけ存在する事で安定した中性な状態となっています。
電子を放出し少なくなっている場合は原子は+の電気を帯びた「陽イオン」となり、
鉄の原子などはこの陽イオンとなる事で最終的に錆が発生している訳です。
化学の世界では電子を放出する事を「酸化する」と言います。

外部リンク【鉄の原子イメージ】
錆びやすい金属とは?
金属が錆びる流れは簡単に言うとこのようになります。
金属が酸素・水分と接触 → 電子を放出し陽イオン化(酸化) → 錆が発生
結局のところ錆はイオン化をするのか?しないか?次第です。
イオン化しやすい(電子を放出しやすい)金属は錆びやすい!
イオン化しにくい(電子を放出しにくい)金属は錆びにくい!
このイオン化のしやすさ(電子の放出しやすさ)をイオン化傾向と言います。
金属の錆びやすさはこのイオン化傾向によって決まっています!
イオン化傾向について
イオン化傾向の大きさは金属原子によって異なります。
各金属のイオン化傾向をまとめたものが下の表です。
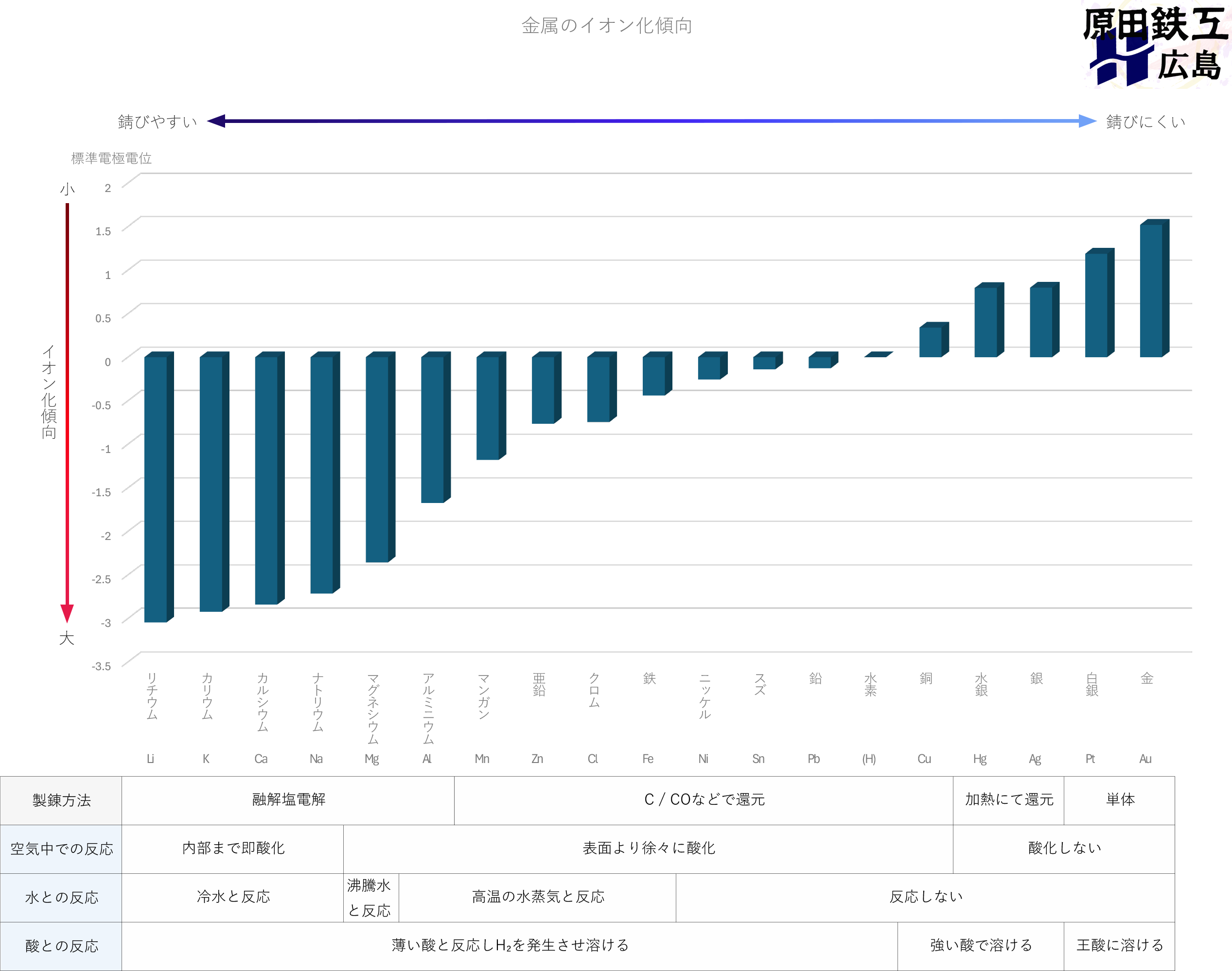
イオン化傾向の大きなリチウムはすぐに酸化されるため、もはや単体で存在する事も難しいです。
逆に金はイオン化傾向が小さくほぼ酸化しないため、単体で存在しています。
金、銀、プラチナなどは希少価値ももちろんですが、酸化しない・変化しない
という事も高価な理由です!
このようにイオン化傾向によって「空気」「水」「酸」との反応が異なります。
このイオン化傾向は「標準電極電位」の値であり、すごく簡単に言うと
電池みたいに2つの金属を組み合わせ発生した電圧を計測したものです。
電気が発生するという事は電気の元となっている電子が移動している事になります。
電圧が大きいほど、多くの電子が移動し金属が酸化している訳です。
なので普段使用している電池の強さも実はイオン化傾向が関係しています。
まとめ
金属は酸素や水分と接触し、金属が電子を放出「陽イオン」となる事で錆びる。
このイオン化は金属によって起こりやすさが異なっているため、
イオン化しやすい金属は錆びやすく、イオン化しにくい金属は錆びにくい。
イオン化のしやすさを「イオン化傾向」と言い、イオン化傾向が大きいのか?
小さいのか?によって金属の錆びやすさを判断する事が出来ます!
原田鉄工では腐食性の高い環境で使用される製品に対しては
ブラスト処理+ジンクリッチペイント塗装を推奨しております。
ジンクリッチペイントとは亜鉛を多く含んだ特殊な下塗塗料です。
ブラスト処理を行った清浄な素地しか塗装する事が出来ませんが、
亜鉛を多く含んだ塗膜は「亜鉛」が「鉄」よりイオン化傾向が大きい事を利用し、
万が一腐食が始まっても先に亜鉛塗料が錆びる事で鉄を守り長持ちします!
【重防食塗装特化の塗装工場】
【塗料の種類について】
